
Иммунотерапия в лечении аденомы и рака простаты, доброкачественной гиперплазии предстательной железы
 Что такое ДГПЖ (аденома простаты) и рак предстательной железы?
Что такое ДГПЖ (аденома простаты) и рак предстательной железы?
ДГПЖ или аденома простаты
Простата – это мужская половая железа, секретирующая семенную жидкость, которая в сочетании со спермой формирует семя (около 95% семенной жидкости состоит из секрета предстательной железы). В течение жизни у большинства взрослых мужчин в генах клеток предстательной железы накапливаются мутационные изменения, приводящие к увеличению размеров простаты или её злокачественному перерождению. Количество мутаций различное у каждого конкретного больного. На Рис. 1 показаны участки хромосом, в которых возникают мутации при доброкачественных и злокачественных заболеваниях предстательной железы.

Рис. 1. Физическая карта хромосом с указанием расположения генов, в которых при заболеваниях предстательной железы обнаруживают мутации
Подобное увеличение предстательной железы носит название "доброкачественная гиперплазия простаты" и вызывает различные нарушения функционирования мочевыводящих путей, степень выраженности которых зависит от стадии гиперплазии. Если при увеличении простаты происходит гиперплазия главным образом железистой ткани, заболевание называют "аденома простаты".
ДГПЖ или аденома простаты наблюдаются примерно у 20% мужчин в возрасте 40 лет, 70% мужчин в возрасте 60 лет и у 90% мужчин в возрасте 80 лет и старше [1, 19, 37, 38]. Поскольку рост простаты обычно происходит довольно медленно, у большинства мужчин не возникает никаких клинических проявлений заболевания, однако примерно у трети из них нарушение самочувствия заставляет обращаться за медицинской помощью. Ранние клинические проявления ДГПЖ или аденомы простаты (ослабление струи мочи, учащение мочеиспускания (как днем, так и ночью – никтурия), недержание мочи и импотенция) могут колебаться от незначительно выраженных до умеренных.
При прогрессировании заболевания аденома простаты вызывает изменения мочевыводящих путей и почек. Увеличивающаяся в размерах аденома приводит к значительному удлинению и сдавлению уретры, что может привести к выраженному растяжению мочевого пузыря вследствие рефлюкса мочи, тяжелым расстройствам мочеиспускания (учащению и затруднению), присоединению инфекций мочевого тракта, почечной недостаточности и острой задержки мочи (дизурии), требующей экстренной катетеризации мочевого пузыря. В случае быстрого прогрессирования заболевания может понадобиться немедленное хирургическое вмешательство.
Наиболее вероятными предшественниками рака предстательной железы считаются аденома простаты и внутриэпителиальная неоплазия предстательной железы. Внутриэпителиальная неоплазия предстательной железы является пролиферативным повреждением, т. е. состоит из клеток эпителия простаты, которые делятся быстрее, чем нормальный эпителий. Однако эти клетки еще не стали опухолевыми [22, 23].
Рак предстательной железы
Рак предстательной железы – вторая по частоте причина смерти мужчин вследствие злокачественных новообразований, уступая только раку легких. По предварительной оценке американского общества борьбы с раком, в течение 2003 года в США будет диагностировано 220 900 новых случаев рака простаты, и 28 900 мужчин умрут от этого заболевания. Рак предстательной железы в течение жизни диагностируют у одного мужчины из шести. Среди мужчин, умерших от рака, 10% умирает именно от рака предстательной железы [3]. У пациентов с ДГПЖ или аденомой простаты рак предстательной железы наблюдается главным образом после 40 лет. Однако, в отличие от ДГПЖ, при раке изменения возникают в любой ткани простаты, а не только в железистых структурах, поэтому злокачественная опухоль может развиться и в неизмененной в размерах, увеличенной или оперированной предстательной железе. Кроме того, в одной и той же простате могут наблюдаться одновременно и рак, и аденома.
На ранних стадиях рак предстательной железы не вызывает каких-либо специфических симптомов. Это является одной из главных причин поздней диагностики заболевания, когда злокачественная опухоль распространяется на соседние ткани и органы (прямую кишку, мочевой пузырь, мочеиспускательный канал).
Традиционные методы лечения и их недостатки
ДГПЖ или аденома простаты
На ранних стадиях ДГПЖ или аденомы простаты нужно включать пациентов в группу динамического наблюдения ("тревожного ожидания" – "watchful waiting"), при необходимости назначая лекарственные препараты (главным образом гормональные препараты и a-адреноблокаторы), физиотерапевтические процедуры и оперативные вмешательства.
Динамическое наблюдение включает в себя ежегодные осмотры, чтобы установить, прогрессируют симптомы заболевания или нет. Это часто дает возможность врачу вовремя назначить медикаментозное или хирургическое лечение.
С наибольшим успехом применяют гормональную терапию – финастерид (проскар, Proscar™) [16, 26, 27, 41].
Из a-адреноблокаторов используют празозин (Minipres™), доксазозин (Cardura™), теразозин (Hytrin™), тамулозин (Flowmax™/Omnic™), алфузозин (Xatral™) [25].
Хотя у большинства пациентов с ДГПЖ эти препараты могут улучшить отток мочи, они не в состоянии остановить рост простаты. С другой стороны, для достижения стойкого терапевтического эффекта указанные средства необходимо применять постоянно, что часто вызывает побочные эффекты (головокружение, незначительное снижение артериального давления, ослабление эрекции), а при отмене a-адреноблокаторов клинические симптомы заболевания возвращаются.
Термотерапия и лазеротерапия – наиболее эффективные физиотерапевтические процедуры, используемые при лечении ДГПЖ или аденомы простаты. Трансуретральную микроволновую термотерапию проводят с использованием специальных аппаратов (Prostatron™, Targis™, Prostalund™). При этом микроволновая энергия по катетеру доставляется внутрь простаты, вызывая значительное повышение температуры, что приводит к локальному разрушению клеток, уменьшению размеров простаты и улучшению оттока мочи [24, 25, 28, 35, 36].
Высокоэнергетические пучковые лазеры применяют при малоинвазивных хирургических вмешательствах. Как и при термотерапии, индуцированная лазером высокая температура вызывает испарение тканевых образований. Для наведения лазерного пучка на простату используют модифицированный цистоскоп или трансректальный ультразвуковой датчик. Наиболее современные и эффективные методики этого вмешательства – лазерное удаление простаты под визуальным контролем (Visual Laser Ablation of the Prostate – VLAP) [30, 31]; контактная лазерная коагуляция, интерстициальная лазерная коагуляция; трансуретральная лазериндуцированная простатэктомия (TransUrethral Laser-Induced Prostatectomy – TULIP) [32, 36]; гольмиево-лазерная резекция простаты (HoLRP) [34]. Лазерная простатэктомия – малоинвазивная альтернатива трансуретральной резекции простаты, но стоимость вмешательства (10 000–12 000 USD) и побочные эффекты, такие как раздражение мочевого пузыря или перманентная ретроградная эякуляция, обусловливают ограниченное применение этого метода.
К хирургическому лечению прибегают для уменьшения выраженности симптомов на поздних стадиях заболевания. Трансуретральная резекция простаты – наиболее успешное и общепринятое вмешательство при ДГПЖ и считается у урологов "золотым стандартом" эффективности лечения. Операцию выполняют без наружного разреза с помощью специального инструмента – резектоскопа – в течение примерно 90 минут. При небольшом увеличении простаты операцией выбора является так называемое трансуретральное надрезание простаты. Трансуретральное надрезание простаты сопровождается меньшим риском развития осложнений (ретроградной эякуляции, импотенции, недержания мочи, кровотечения), чем трансуретральная резекция простаты [25, 33, 36, 39, 40].
Следующее недавнее достижение – использование простатических стентов. Они представляют собой специальные спирали из титана с добавлением золота, которые проводят под визуальным контролем через половой член для смещения простаты в сторону, что уменьшает проявления заболеваний предстательной железы. Основные преимущества этого метода – быстрота и легкость выполнения при относительно хороших результатах. Недостатки – смещение положения стента, а также учащение опорожнения мочевого пузыря вследствие раздражения из-за манипуляции [25, 36].
В том случае, если простата достигает больших размеров, выполняют открытую простатэктомию. Конечные результаты при этой операции намного лучше, чем при прочих методах лечения, хотя и очевиден более высокий хирургический риск. Существенные недостатки открытой простатэктомии, кроме обычного хирургического риска, – ретроградная эякуляция (приводящая к бесплодию) и возможность возвращения со временем симптомов болезни.
Рак предстательной железы
В настоящее время при раке простаты применяют весь спектр методов лечения, разработанных для других типов злокачественных опухолей, последовательно переходя от динамического наблюдения, гормональной терапии, химиотерапии, криотерапии, лучевой терапии к радикальным операциям.
Лечение рака простаты должно быть индивидуальным. Выбор оптимального метода лечения должен основываться на оценке клинической стадии и гистологического типа опухоли, количества баллов по шкале Gleason [43, 44, 45], уровня простатоспецифичного антигена (prostate specific antigen – PSA) [42, 47, 48, 49, 51], а также состояния пациента – возраста, социального статуса, наличия или отсутствия сопутствующих заболеваний и т. д. Существуют таблицы Партина (Partin coefficient tables) [52], в которых дается комплексная оценка уровня PSA, количества баллов по шкале Gleason и клинической стадии рака, разработанные группой урологов из урологического института Брэйди (Brady Institute for Urology) и университета Джона Хопкинса (Johns Hopkins University) (пересмотренные в мае 1997). Их используют для определения стадии рака простаты, что исключительно важно в плане выработки тактики лечения пациента.
В группу динамического наблюдения должны быть включены пациенты с очень ранними стадиями рака простаты, когда количество и размер опухолевых клеток очень малы (что определено оценкой уровня PSA и данных биопсии), а степень злокачественности опухоли низкая (количество баллов по шкале Gleason 6 и менее). Главными преимуществами динамического наблюдения является отсутствие тяжелых побочных эффектов хирургического вмешательства, лучевой терапии или гормонального лечения, а также связанных с лечением расходов. С другой стороны, при такой тактике очевиден риск быстрого роста раковой опухоли в промежутке между контрольными осмотрами [53, 54, 55].
Гормональная терапия (направленная на подавление образования андрогенов) обычно применяется при поздних стадиях рака простаты и может быть назначена совместно с лучевой терапией или после простатэктомии, особенно при высоком риске рецидивирования. В качестве основного компонента традиционного лечения андрогены используются при наиболее агрессивных опухолях, а также при невозможности осуществления хирургического вмешательства или лучевой терапии.
Комбинация гормонотерапии и химиотерапии при лечении рака простаты в настоящее время проходят стадию клинических испытаний [56, 58] с целью оценки ее эффективности.
Химиотерапию используют главным образом при раке простаты, рефрактерному к гормональной терапии. Наиболее успешным оказалось назначение митаксантрона (Mitaxantronе) совместно с преднизолоном, а также эстрамустина (Emcyt), хотя это лечение и сопровождалось ожидаемыми побочными эффектами – выпадением волос, лейкопенией, анемией и тошнотой [57, 59, 60, 61, 62].
Криотерапия (лечение низкими температурами) или криохирургия [46] считается одним из самых потенциально эффективных современных методов лечения, применяемых для терапии первичной опухоли или рецидивов рака простаты после лучевой терапии. Криотерапия может быть альтернативой лучевой терапии у пациентов с симптомами обструкции мочевыводящих путей, на долгое время устраняя препятствия для оттока мочи. Отдаленные результаты пока не получены, а побочные эффекты (импотенция и недержание мочи) ограничивает применение криотерапии указанными рамками [46, 64, 65, 66].
Лучевая терапия – следующее основное традиционное направление в послеоперационном лечении рака простаты. Схемы лучевой терапии [55, 67, 65] и комбинированного лечения детально разработаны для различных стадий рака простаты. Именно лучевая терапия является методом выбора для тех групп пациентов, у которых хирургическое вмешательство сопровождается слишком большим риском, например, для пожилых или имеющих тяжелые сопутствующие заболевания людей. С повышением точности направленности лучевой терапии этот метод будет применяться и у молодых пациентов.
Однако лучевая терапия далеко не всегда отвечает современным требованиям к лечению заболеваний предстательной железы. Например, при поздних стадиях рака (8-10 баллов по шкале Gleason) лучевая терапия менее эффективна, чем хирургическое вмешательство. Лучевая терапия строго направлена, и при наличии метастазов она не может являться радикальным средством. Наиболее эффективна лучевая терапия при паллиативном лечении костных метастазов рака простаты, главным образом для купирования болевого синдрома.
С другой стороны, каким бы прицельным не был пучок радиоактивных лучей, близлежащие ткани также подвергаются облучению, да и неблагоприятное влияние локальной лучевой терапии на весь организм может быть лишь сведено к минимуму, но не устранено полностью. Таким образом, отдаленные побочные эффекты – иммуносупрессия, лейкопения, анемия, тошнота – обусловливают неоднозначность и ограниченность применения этого метода лечения. Как и при других локализациях раковых опухолей, наилучшие отдаленные результаты наблюдаются при радикальном хирургическом лечении – радикальной простатэктомии с сохранением иннервации или без нее.
Хирургические методы применяют главным образом у относительно молодых пациентов с опухолями стадии Т2 (или 7 баллов по шкале Gleason). Более того, разработанные недавно технологии (вмешательства с сохранением семенных пузырьков, лапароскопические манипуляции) не только сводят к минимуму хирургические осложнения (риск наркоза, опасность кровотечения, хирургическую интра-и послеоперационную смертность) и длительность пребывания пациентов в стационаре, но также значительно удлиняют продолжительность жизни больных раком простаты. Оперативное лечение редко применяется у пациентов старше 70 лет, т. к. хирургический риск не менее велик, чем возможные благоприятные результаты операции.
Отрицательными сторонами хирургического лечения могут оказаться импотенция и неспособность поддерживать эрекцию на достаточном уровне. Кроме того, после операции возможно недержание мочи (может быть временным или постоянным), снижение эякуляции и фертильности. Хирургическое лечение метастатических и андроген-независимых опухолей простаты применяется ограниченно и в большинстве случаев неудовлетворительно [28, 44, 50, 54].
Современный подход к лечению
Достижения применения традиционных методов лечения, описанных выше, ограничены. С одной стороны, врачи руководствуются этими методами уже в течение многих лет, с другой стороны, неуклонно увеличивающееся число заболеваний простаты побуждает исследователей разрабатывать более эффективные альтернативные методы.
Среди современных разработок в лечении опухолей можно выделить ангиостатический подход, направленный на прекращение кровоснабжения раковой опухоли, демонстрирующий многообещающие результаты.
Иммунотерапия основана на достижениях молекулярной биологии и генетики и является современным методом лечения рака предстательной железы, главным образом его наиболее агрессивных гистологических типов [10, 16]. В течение последнего десятилетия ученые приступили к разработке сотен иммунотерапевтических препаратов и вакцин, которые находятся на разных этапах клинических испытаний.
Одним из таких лекарственных препаратов для лечения рака опухолевых и предопухолевых заболеваний простаты является вакцина РЕСАН.
Необходимо отметить, что рак простаты, к сожалению, часто рецидивирует после достаточно успешного традиционного лечения. Поэтому применение вакцины РЕСАН может сыграть уникальную роль в профилактике и лечении рака простаты, спасти и продлить жизнь многим пациентам.
Преимущества иммунотерапии
В настоящее время совершенно очевидно, что раковые опухоли развиваются у людей со слабым иммунным ответом, и только при адекватной иммунотерапии может восстановиться иммунологическая реактивность, обеспечивающая борьбу с раком.
В последние годы были изучены важнейшие компоненты эффективного иммунного ответа. Понимание механизмов дисфункции одного или нескольких звеньев иммунного ответа привело к появлению различных направлений иммунотерапии: 1) стимуляция пролиферации дендритных клеток; 2) содействие захвату антигена и его процессингу; 3) стимуляция ответа эффекторных клеток при помощи прямой презентации антигена; 4) элиминация раковой опухоли с помощью антител.
Именно предстательная железа является уникальным местом приложения для иммунотерапии, т. к. простатоспецифический иммунитет формируется довольно легко. Антитела и клеточно-опосредованный иммунитет, выработанные либо активной, либо пассивной иммунизацией, потенциально способны специфически элиминировать в предстательной железе злокачественные клетки [21].
Хотя при раковой опухоли, не выходящей за пределы простаты, в большинстве случаев эффективна радикальная простатэктомия, лечение метастатического и андроген-независимого рака предстательной железы пока не приводит к желаемым результатам [16].
Простатоспецифичный антиген (PSA) является мишенью при иммунотерапии рака простаты, т. к. степень его экспрессии очень высока и регулируется уровнем андрогенов [17, 29].
Вакцина PSA вызывает образование антител к множеству поверхностных этитопов или детерминант антигенов клеток рака простаты [21, 29].
Анализ иммунологических показателей продемонстрировал, что у большинства пациентов в ответ на вакцинацию наблюдалось увеличение продукции цитокинов, специфических антител и пролиферации Т-клеток. Это позволяет предположить, что иммунотерапия при прогрессирующих опухолях окажется достаточно эффективной [20].
Многие опухольассоциированные антигены слабо иммуногенны, и к ним часто возникает иммунологическая толерантность. Результаты некоторых исследований продемонстрировали, что ксеноантигенная иммунизация у человека может нарушить толерантность к собственным антигенам, приводя к клинически выраженному противоопухолевому эффекту [18].
Каким образом вакцина РЕСАН может помочь при этих заболеваниях?
Противоопухолевая вакцина РЕСАН, кроме аналога 22 пептидных фрагментов теломеразы (hTRT), содержит более 40 различных имитаторов опухольспецифичных антигенов, включая имитаторы определенных эпитопов простатоспецифичного антигена.
На Рис. 2 и Рис. 3 показана аминокислотная последовательность двух антигенов рака простаты. Выделены и подчёркнуты те фрагменты этих антигенов, которые имитирует вакцина РЕСАН. Рис. 4 дает представление о пространственной структуре простатоспецифичного антигена.
Рис. 2. Простатоспецифичный мембранный антиген
(PROSTATE–SPECIFIC MEMBRANE ANTIGEN. HUMAN)
mwnllhetdsavatarrprwlcagalvlaggffllgflfgwfikssneatn itpkhnmkafldelkaenikkflhnftqiphlagteqnfqlakqiqsqwke fgldsvelahydvllsypnkthpnyisiinedgneifntslfeppppgyen vsdivppfsafspqgmpegdlvyvnyartedffklerdmkincsgkiviar ygkvfrgnkvknaqlagakgvilysdpadyfapgvksypdgwnlpgggvqr gnilnlngagdpltpgypaneyayrrgiaeavglpsipvhpigyydaqkll ekmggsappdsswrgslkvpynvgpgftgnfstqkvkmhihstnevtriyn vigtlrgavepdryvilgghrdswvfggidpqsgaavvheivrsfgtlkke gwrprrtilfaswdaeefgllgstewaeensrllqergvayinadssiegn ytlrvdctplmyslvhnltkelkspdegfegkslyeswtkkspspefsgmp risklgsgndfevffqrlgiasgrarytknwetnkfsgyplyhsvyetyel vekfydpmfkyhltvaqvrggmvfelansivlpfdcrdyavvlrkyadkiy sismkhpqemktysvsfdslfsavknfteiaskfserlqdfdksnpivlrm mndqlmflerafidplglpdrpfyrhviyapsshnkyagesfpgiydalfd ieskvdpskawgevkrqiyvaaftvqaaaetlseva
Рис. 3. Предшественник простатоспецифичного антигена
(PROSTATE SPECIFIC ANTIGEN PRECURSOR (PSA). HUMAN)
mwvpvvfltlsvtwigaaplilsrivggwecekhsqpwqvlvasrgravcggv lvhpqwvltaahcirnksvillgrhslfhpedtgqvfqvshsfphplydmsll knrflrpgddsshdlmllrlsepaeltdavkvmdlptqepalgttcyasgwgs iepeefltpkklqcvdlhvisndvcaqvhpqkvtkfmlcagrwtggkstcsgd sggplvcngvlqgitswgsepcalperpslytkvvhyrkwikdtivanp
 Рис. 4. Пространственная структура простатоспецифичного антигена. Желтым цветом обозначены фрагменты антигена (эпитоты), которые имитирует вакцина РЕСАН
Рис. 4. Пространственная структура простатоспецифичного антигена. Желтым цветом обозначены фрагменты антигена (эпитоты), которые имитирует вакцина РЕСАН
Благодаря подобранной комбинации имитаторов эпитопов опухолевых антигенов вакцина РЕСАН способна индуцировать выраженный ответ против опухоли простаты. Более того, гликопротеиновые структуры, входящие в состав вакцины, играют важную роль в усилении этого иммунного ответа. Противораковые вакцины именно этого типа ученые всего мира разрабатывают в течение последнего десятилетия. Вакцина эффективна при лечении ДГПЖ и рака простаты. При ее рациональном использовании результаты весьма многообещающи. У пациентов с ДГПЖ или аденомой простаты иммунотерапию можно проводить без сочетания с какими-либо другими лекарственными препаратами. В течение 4 – 6 недель после вакцинации наблюдается регрессия размеров простаты, нормализация уровня PSA и выраженное клиническое улучшение состояния пациента. В случае рака простаты наилучшие результаты наблюдаются при комбинации введения вакцины с хирургическим лечением – задерживается развитие или происходит регрессирование метастазов, разрушаются микрометастазы, предотвращается рецидивирование, что приводит к долговременной ремиссии. Об эффективности лечения свидетельствуют снижение уровня опухолевого маркера, изменение уровня цитокинов и уменьшение размеров опухоли по данным КТ и УЗИ.
Препарат РЕСАН может быть рекомендован в качестве альтернативного метода лечения рака простаты, если операция невозможна или сопровождается слишком большим риском, т. к. это неинвазивный, не токсичный и не деструктивный метод, основанный на активации собственной системы иммунитета пациента.
Как указано выше, рак предстательной железы может развиваться на фоне ДГПЖ (аденомы простаты) и внутриэпителиальной неоплазии простаты. Более того, аденома простаты может маскировать проявления начального периода рака простаты. В этих случаях уровень PSA может находиться в пределах от 4 до 10 нг/мл. Если уровень PSA более 10 нг/мл, диагноз рака простаты не вызывает больших сомнений. Если же уровень PSA от 4 до 10 нг/мл, сложно решить, имеем мы дело с аденомой или же это начальная стадия рака простаты (или рецидив заболевания после радикального лечения). С другой стороны, как раз при значениях PSA от 4 до 10 нг/мл использование вакцины для лечения или предотвращения развития рака наиболее эффективно, приводя к полной нормализации уровня PSA у 90% пациентов в течение 1-2 месяцев после введения вакцины. (См. профилактическая вакцинация групп риска).
Вакцина РЕСАН не имеет существенных побочных эффектов и безопасна для применения при всех стадиях опухолей. Она может быть рекомендована даже пациентам с поздними стадиями опухолей, при неэффективности традиционных методов лечения и при рецидивировании опухоли после традиционных методов лечения (См. новый подход к лечению поздних стадий злокачественных опухолей).
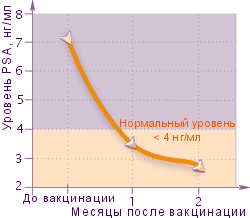 Рис. 5. Снижение уровня PSA после вакцинации
Рис. 5. Снижение уровня PSA после вакцинации
Применение вакцины РЕСАН эффективно также у пациентов из группы динамического наблюдения по поводу ДГПЖ и аденомы простаты. Для них именно введение вакцины является первоочередным выбором лечения с реальными шансами на полное выздоровление (в зависимости от стадии заболевания) и предупреждение злокачественного перерождения.
Нa Рис. 5 продемонстрированы изменения в уровне PSA после вакцинации РЕСАН у пациентов с заболеваниями предстательной железы.
Эффективность применения вакцины РЕСАН при ДГПЖ и аденоме простаты
При гистологическом исследовании аденомы обнаруживают железистые образования, выстланные цилиндрическим эпителием, кистозные полости, волокна соединительной и мышечной ткани. В зависимости от преобладания той или иной ткани различают 4 формы ДГПЖ, от чего и зависит эффективность иммунотерапии препаратом РЕСАН.
1. При преобладании железистой ткани (аденома) иммунотерапия эффективна примерно в 80-85% случаев. В этих случаях, как минимум, происходит остановка роста аденомы или ее частичная регрессия и восстановление оттока мочи, нормализация функций мочевыделительной системы, как максимум – полное исчезновение аденомы.
2. При преобладании фиброзной ткани (фиброаденома) иммунотерапия эффективна примерно в 80-85% случаев.
3. При преобладании мышечной ткани (аденомиома) иммунотерапия эффективна примерно в 50-60% случаев.
4. При смешанных формах неоплазии иммунотерапия эффективна примерно в 60-85% случаев.Наиболее часто развиваются две первые гистологические формы.
Препараты, применяемые совместно с вакциной РЕСАН
Аспирин. С 7 дня после введения вакцины по 0,125 мг утром и вечером. Продолжительность курса – 3 месяца. При некоторых сопутствующих заболеваниях (язвенная болезнь, бронхиальная астма, тромбоцитопеническая пурпура) аспирин не применяется.
Проскар является синтетическим ингибитором 5-a-редуктазы.
Считается одним из наиболее эффективных существующих препаратов для лечения аденомы предстательной железы, должен применяться по 5 мг 1 раз в сутки не менее 6 месяцев.
Пермиксон – аналог проскара растительного происхождения (у ряда больных менее эффективен, чем проскар) применяют в дозе 160 мг (2 таблетки по 80 мг каждая) 2 раза в день в течение не менее 6 месяцев.
Омник – ингибитор a-1-адренорецепторов, расположенных в шейке
мочевого пузыря – имеет смысл применять только для ликвидации выраженных дизурических явлений (дозировка – 0,4 мг 1 раз в сутки).
Применение вакцины РЕСАН совместно с общепринятой системой ведения больных с заболеваниями предстательной железы может сыграть уникальную роль в профилактике и лечении доброкачественной и злокачественной патологии простаты.
Информационные источники
1.Prostate Cancer. No One Answer for Testing or Treatment.
John Henkel. FDA/Office of Public Affairs. Online.
2.MedNews Screening for prostate cancer. Digital Rectal Examination and Prostate Specific Antigen.
NCI. Online.
3.What Are The Key Statistics About Prostate.
2002 © American Cancer Society, Inc.
4.Natural anti-Gal antibody as a universal augmenter of autologous tumor vaccine immunogenicity.
Immunology Today. vol.18, No. 6, june 1997, pp. 281-285.
Uri Galili and Denise C. LaTempl.
5.Tumor antigens recognized by T cells.
Immunology Today. vol.18, No. 6, june 1997, pp. 267-268.
Thierry Boon, Pierre G. Coulie and Benoit Van den eyde.
6.Gene therapy of prostate cancer: current and future directions.
Endocr Relat Cancer 2002 Jun;9(2):115-39.
Mabjeesh NJ, Zhong H, Simons JW. Winship Cancer Institute, Department of Hematology and Oncology, Emory University School of Medicine, 1365 Clifton Road, Suite B4100, Atlanta, Georgia 30322, USA.
7.PATE, a gene expressed in prostate cancer, normal prostate, and testis, identified by a functional genomic approach.
Proc Natl Acad Sci USA 2002 Mar 5;99(5):3058-63.
Bera TK, Maitra R, Iavarone C, Salvatore G, Kumar V, Vincent JJ, Sathyanarayana BK, Duray P, Lee BK, Pastan I. Laboratory of Molecular Biology and Laboratory of Pathology, Center for Cancer Research, National Cancer Institute, National Institutes of Health, Bethesda, MD 20892, USA.
8.Heterogeneous expression of MAGE-A genes in occult disseminated tumor cells: a novel multimarker reverse transcription-polymerase chain reaction for diagnosis of micrometastatic disease.
Cancer Res 2002 Jan 1;62(1):251-61.
Kufer P, Zippelius A, Lutterbuse R, Mecklenburg I, Enzmann T, Montag A, Weckermann D, Passlick B, Prang N, Reichardt P, Dugas M, Kollermann MW, Pantel K, Riethmuller G. Institute of Immunology, University of Munich, 80336 Munich, Germany.
9.Analysis of endogenous peptides bound by soluble MHC class I molecules: a novel approach for identifying tumor-specific antigens.
Eur J Immunol 2002 Jan;32(1):213-22.
Barnea E, Beer I, Patoka R, Ziv T, Kessler O, Tzehoval E, Eisenbach L, Zavazava N, Admon A.The Smoler Protein Center, Department of Biology, Technion, Haifa, Israel.
10.Gene therapy of prostate cancer: current and future directions.
Mabjeesh NJ, Zhong H, Simons JW.Winship Cancer Institute, Department of Hematology and Oncology, Emory University School of Medicine, 1365 Clifton Road, Suite B4100, Atlanta, Georgia 30322, USA.
11.TAP off-Tumors on. Immunology Today.
vol.18, No. 6, june 1997, pp.292- 298.
Immunology Today. Barbara Seliger, Marcus J. Maeurer and Soldano Ferrone.
12.Prostate specific antigen inhibits immune responses in vitro: a potential role in prostate cancer.
J Urol 2002 Aug;168(2):741-7.
Kennedy-Smith AG, McKenzie JL, Owen MC, Davidson PJ, Vuckovic S, Hart DN. Urology Department and Haematology Research Group, Christchurch Hospital and Molecular Pathology, Canterbury Health Laboratories, Christchurch, New Zealand.
13.Prostate stem cell antigen: Identification of immunogenic peptides and assessment of reactive CD8+T cells in prostate cancer patients.
Int J Cancer 2002 Dec 1;102(4):390-7.
Kiessling A, Schmitz M, Stevanovic S, Weigle B, Holig K, Fussel M, Fussel S, Meye A, Wirth MP, Rieber EP. Institute of Immunology, Medical Faculty, Technical University of Dresden, Dresden, Germany.
14.Role of prostate stem cell antigen in prostate cancer research.
Curr Opin Urol 2002 Sep;12(5):401-6.
Jalkut MW, Reiter RE. Department of Urology, University of California - Los Angeles School of Medicine, Los Angeles, California, USA.
15.Immunotherapy for prostate cancer.
Rini BI, Small EJ.University of California at San Francisco Comprehensive Cancer Center, 1600 Divisidero Street, 3rd floor, San Francisco, CA 94115, USA.
16.Proscar Pronounced: PRAHS-car, Generic name: Finasteride.
17.A unique folate hydrolase, prostate-specific membrane antigen (PSMA): a target for immunotherapy?
Tasch J, Gong M, Sadelain M, Heston WD.Department of Urology, Memorial Hospital, Memorial Sloan-Kettering Cancer Center, New York, NY 10021, USA.
18.Dendritic cell-based xenoantigen vaccination for prostate cancer immunotherapy.
Fong L, Brockstedt D, Benike C, Breen JK, Strang G, Ruegg CL, Engleman EG. Department of Pathology, Stanford University School of Medicine, Palo Alto, CA 94304, USA.
19.Ward Dean MD. Preventing and treating men’s prostate problems. Ward Dean MD. Online.
20.Allogeneic whole-cell vaccine: a phase I/II study in men with hormone-refractory prostate cancer.
Eaton JD, Perry MJ, Nicholson S, Guckian M, Russell N, Whelan M, Kirby RS. Division of Oncology, St George's Hospital Medical School, London, UK.
21.Evidence of determinant spreading in the antibody responses to prostate cell surface antigens in patients immunized with prostate-specific antigen.
Clin Cancer Res 2002 Feb;8(2):368-73.
Cavacini LA, Duval M, Eder JP, Posner MR. Beth Israel Deaconess Medical Center, 21-27 Burlington Avenue, Room 556, Boston, MA 02215, USA.
22.Prostatic Intraepithelial Neoplasia.
David G. Bostwick, MD, MBA, FCAP. Dharam ramani, MD, ECAP. 2001 Bostwick Laboratories. Online.
23.Prostatic intraepithelial neoplasia is a risk factor for adenocarcinoma. Predictive accuracy in needle biopsies.
Journal of Urology 1995; 154:1295-99.
Davidson D, Bostwick DG, Qian J, et al.
24.TransUrethral Microwave Thermotherapy Using the Prostatron™.
A. Non-Surgical Breakthrough in BPH Treatment. Kankakee Urological Associates, LTD * Riverside Medical Center. Online.
25.UROlog, BPH treatment.
Based on information from various sources. Online.
26.Effectiveness of Proscar in Treating Enlarged Prostates.
Susan A. Steeves. University of Texas Southwestern Medical Center 25-Feb-98.
27.PROSCAR® (Finasteride).
Tablets Patient Information about PROSCAR ® (Prahs-car). Online.
28.How Is Prostate Cancer Treated? Americal foundation for Urologic Disease. Online.
29.The latest research on immune therapy for prostate cancer.
Prostate Cancer Information Centre. infoaging.org Online.
30.Laser ablation of the prostate in patients with benign prostatic hypertrophy.
Costello AJ, Bowsher WG, Bolton DM, Braslis KG, Burt J. Br J U 1992; 69:603-8.
31.VISUAL LASER ABLATION OF THE PROSTATE (VLAP) WITH BARE FIBER IN CONJUNCTION WITH LASER BLADDER NECK INCISION IN THE TREATMENT OF PATIENTS WITH BENIGN PROSTATIC HYPERPLASIA (BPH).
Ann Saudi Med 1997; 17(2):191-194.
Hasan M. A. Farsi, FACS, FRCS(C); Hisham A. Mosli, FACS, FRCS(C);
Mohammed F. Alzemaity, FACS, FRCS(C); Ahmed Bahnasy, MD, PhD.
32.Laser Prostatectomy for Benign Prostatic Hypertrophy.
The Regence Group, Medical Policy. Revised/Effective Date: 01/08/2002. Online.
33.TUIP (transurethrale Inzision der Prostata) f?r BPH (benigne Prostatahyperplasie .
Prostatitis. neu in 2001. Online.
34.Holmium:YAG Laser Resection of the Prostate Versus Visual LaserAblation of the Prostate and Transurethral Ultrasound-Guided Laser Induced Prostatectomy. A Retrospective Comparative Study.
Journal of Endourology, Vol.5, Number 2, 152-156, Mar 1998.
Kitagawa M, Furuse H, Fukuta K, Aso Y.
35.Minimally Invasive BPH Treatments , Laser Surgery BPH Treatment, Transurethral Microwave Thermotherapy (TUMT), Transurethral Needle Ablation (TUNA®).
©Ethicon Endo-Surgery, Inc. 2001, 2002. Online.
36.CORNELL Physicians, BPH, Surgical Treatments , Surgery; TURP and TUIP, Minimally Invasive Procedures: Laser prostatectomy, Transurethral thermotherapy, Transurethral needle ablation (TUNA), Prostatic stents, Transurethral electrovaporization. Online.
37.Benign prostatic hyperplasia.
Victoria Kennedy, RN, A.D.A.M. editorial (11/14/2001). Department of Urology, New York-Presbyterian Hospital Columbia Campus, New York, NY. Online.
38.Prostate Cancer UK, BHP (Benign Prostatic Hyperplasia). Online.
39.Prostate Cancer UK, Transurethral Resection of the Prostate (TURP). Online.
40.Transurethral resection of the prostate (TURP) for benign prostatic hyperplasia (BPH), Surgery Overview.
Healthwise, Incorporated, P.O. Box 1989, Boise, ID 8370. Last Updated January 21, 2002. Online.
42.Prostate Cancer UK, Prostate-Specific Antigen (PSA). Online.
43.The Prostate Centre, Gleason Grade. Online.
44.Salvage radical prostatectomy for radiorecurrent prostate cancer: morbidity revisited.
Vaidya A, Soloway MS. J Urol 2000;164:1998-2001. Online.
45.Understanding Gleason Grading, Prostate Cancer UK. Online.
46.Cryotherapy.
Drs. Werner, Murdock & Francis; P.A. Greenbelt - Laurel - Bowie, Maryland. Online - UROLOGY ASSOCIATES.
47.Prostate Doctor, Prostate Cancer Diagnosis: What you should know. Online.
48.The Doctor's Doctor, PSA (prostate specific antigen). Online.
49.PSA RapidScreen Test.
CRAIG MEDICAL DISTRIBUTION INC. Online.
50.Doctor's Guide Publishing Limited. Radical prostatectomy often results in impotence and urinary incontinence. Online.
51.Patient Information PSA (prostate-specific antigen) Screening for Prostate Cancer.
Journal of Family Practice 1993;37(5):435-6.
Hahn and Roberts.
52.Partin Tables, Prostate Cancer UK. Online.
The probability that the patient has 1) completely organ-confined disease
2) established capsular penetration 3)extension of his prostate cancer into his seminal vesicles. 4) prostate cancer which has spread into his lymph nodes.
53.MARIN UROLOGY. Vernon E. Weldon, M.D., Harry Neuwirth, M.D., Patrick M. Bennett, M.D. Watchful Waiting. Online.
54.Family Practice Notebook, Radical Prostatectomy by Scott Moses, MD, last revised 9/29/2002. Online.
55.Treatment of Prostate Cancer: Radioactive Seed Implantation , (Brachytherapy).
Duke K. Bahn, M.D. Department of Radiology, Crittenton Hospital, Rochester, MI (248) 652-5611.
56.Hormone Therapy Plus Chemotherapy in Treating Patients With Prostate Cancer.
ClinicalTrials.gov processed the record on 2002-12-08. Online.
57.Chemotherapy for Prostate Cancer.
UPMC cancer centres. Online.
58.Prostate Cancer UK, Hormone Therapy. Online.
59.PROSTATE CANCER Treatment: Advanced Systemic Disease.
U-M Comprehensive Cancer Center. Online.
60.Chemotherapy Combination Promising for Advanced Prostate Cancer. Taxotere and Emcyt Phase II Report.
New York, May 7, 2001 (PSA Rising).
61.Taxotere®/Estramustine/Prednisone: New Standard of Care for Hormone-Refractory Prostate Cancer?
© CancerConsultants.com
62.CHEMOTHERAPY.
Drs. E. David Crawford, Aubrey Pilgrim, Stephen Strum, Israel Barken, Bob Leibowitz and Contributions from Several Survivors.
63.Brachytherapy for Prostate Cancer - Recovery Complications, Medicines and Heart Concerns.
© Thomas P. Doherty, December 22, 2000.
64.Cryotherapy (Freezing) Treatment for Localized Prostate Cancer.
William D. Steers, M.D. Chair Jay Y. Gillenwater, M.D. Mikel L. Gray, Ph.D. Stuart S. Howards, M.D. Alan D. Jenkins, M.D. Marguerite C. Lippert, M.D. William H. Sipe, M.D. Dan Theodorescu, M.D., Ph.D. Arthur W. Wyker, M.D. Prostate Center and Department of Urology (434) 924-2224.
65.Prostate Radioactive Seed Implantation. The Newest Alternative for Treating Early Prostate Cancer.
Radiation Medical Group, Inc. Online.
66.Cryosurgery in the Treatment of Prostate Cancer.
Duke K. Bahn, M.D. Department of Radiology, Crittenton Hospital, Rochester, MI (248) 652-5611.







